
Gốc axit là gì? Đây là thuật ngữ khá quen thuộc trong các môn hóa học và trong lĩnh vực nghiên cứu hóa học hay sức khỏe. Tuy nhiên, không phải ai cũng có thể nhớ, hiểu và vận dụng tốt những kiến thức về axit. Trong bài viết này, Vietchem sẽ phân chi tiết về gốc axit và những ứng dụng của chúng.
1. Gốc axit là gì ?
Axit là một trong những phân tử hóa học được cấu tạo bởi nguyên tử Hydro và gốc axit. Chính vì thế, để thu được gốc Axit thì chúng ta chỉ cần tách nguyên tử Hydro ra khỏi phân tử hóa học mà thôi.

Ảnh 1: Gốc axit có thể tìm thấy nhiều ở môi trường xung quanh chúng ta
Gốc Axit có thể tìm thấy ở rất nhiều môi trường, thực vật, thực phẩm hàng ngày như hoa quả có vị chua, chanh,... Thậm chí, ngay cả nguồn nước mà chúng ta sử dụng hàng ngày nếu không được lọc sạch cũng có thể chứa những Gốc axit.
Gốc Axit còn chứa trong nhiều loại đồ uống chẳng hạn như bia, rượu, đồ uống chứa gas, cồn, các loại thực phẩm giàu chất béo,... Khi cơ thể dung nạp những đồ uống hoặc thực phẩm mang tính axit hoặc chứa nhiều gốc axit về lâu dài sẽ gây ra nhiều vấn đề không tốt cho cơ thể, thậm chí là cả nguy cơ bệnh tật.
2. Phân loại gốc axit gồm những gì?
Dựa vào cấu trúc của chúng, người ta chia axit thành 2 loại: gốc axit có hydro và axit không có hydro:
2.1. Gốc axit có hydro
Gốc axit với hydro: -HSO4, =HPO4, -H2PO4
2.2. Gốc axit không có hydro
Gốc axit không có hydro: -Cl, -NO3, =SO4, PO4
Ngoài ra, người ta còn phân loại axit thành axit có oxy và axit không có oxy:
Gốc axit với oxy: -NO3, =SO4, PO4
Các gốc axit không chứa oxy: -Cl, -Br, -F, -I

Hình 2: Phân loại các gốc axit dựa vào đặc tính của chúng
Công thức và cách gọi tên từng gốc axit
Axit và gốc axit
STT
Công thức axit
Tên gọi Axit
Khối lượng axit (đvC)
Công thức gốc axit
Tên gọi gốc axit
Hóa trị
Khối Lượng Gốc Axit (đvC)
1
HCl
Axit clohidric
36.5
-Cl
Clorua
I
35.5
2
HBr
Axit bromhidric
81
-Br
Bromua
I
80
3
HF
Axit flohidric
20
-F
Florua
I
19
4
HI
Axit iothidric
128
-I
Iotdua
I
127
5
HNO3
Axit nitric
63
-NO3
Nitrat
I
62
6
HNO2
Axit nitric
47
-NO2
Nitrit
I
46
7
H2CO3
Axit cacbonic
62
=CO3
Cacbonat
II
60
-HCO3
Hidrocacbonat
I
61
8
H2SO4
Axit sunfuric
98
=SO4
Sunfat
II
96
-HSO4
Hidro Sunfat
I
97
9
H2SO3
Axit sunfuric
82
=SO3
Sunfit
II
80
-HSO3
Hidro Sunfua
I
81
10
H3PO4
Axit photphoric
98
PO4
Photphat
III
95
-H2PO4
Dihydro Photphat
I
97
=HPO4
Hidro Photphat
II
96
☰PO4
Photphat
III
95
11
H3PO3
Axit photphoric
82
☰PO3
Photphat
III
79
-H2PO3
Đihiđrophotphit
I
81
=HPO3
Hidrophotphat
II
80
12
H2SO3
Axit Sunfit
82
=SO3
Sunfit
II
80
-HSO3
Hidro sunphit
I
81
13
H2CO3
Axit Cacbonic
62
=CO3
Cacbonat
II
60
-HCO3
Hidrocacbonat
I
61
14
H2S
Axit Sunfuhiđric
34
=S
Sunfua
II
32
-HS
Hidro Sunfua
I
33
15
H2SiO3
Axit silicic
78
=SiO3
Silicat
II
76
-HSiO3
Hidro Silicat
I
77
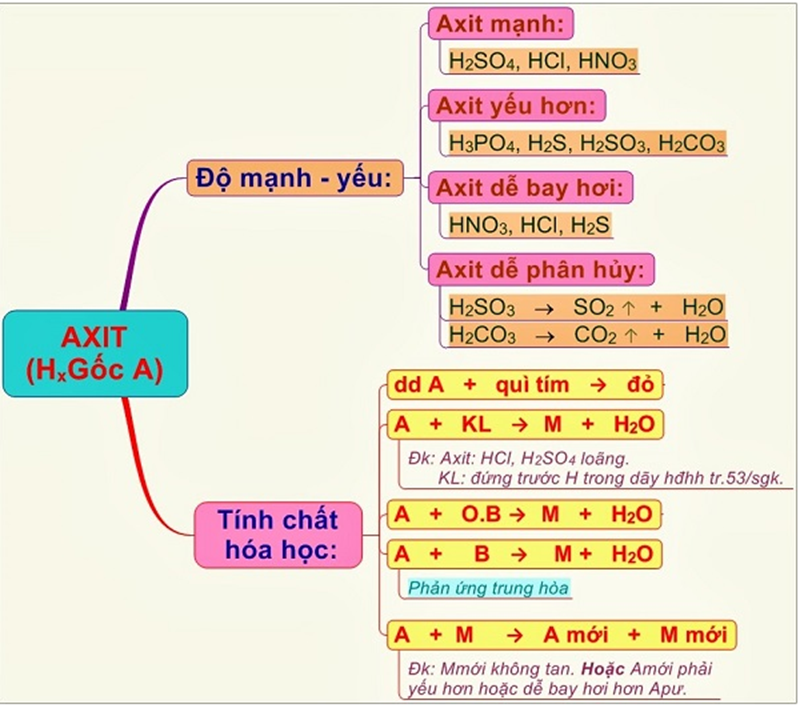
3. Tính chất hóa học của axit
Cùng tìm hiểu về một số tính chất hóa học của Axit để hiểu thêm về gốc axit:
3.1. Axit làm đổi màu giấy quỳ tím
Ta thực hiện thí nghiệm nhỏ vài giọt dung dịch HCL vào giấy quỳ tím và sau đó quan sát ta nhận thấy rằng màu của nó thay đổi chuyển sang màu đỏ. Do đó ta có thể kết luận rằng dung dịch axit làm đổi màu giấy quỳ tím thành đỏ.
Vì vậy, dựa vào tính chất này, giấy quỳ tím được dùng để nhận biết dung dịch axit.
3.2. Axit tác dụng với kim loại
Khi cho dung dịch Axit tác dụng với các kim loại đứng trước nguyên tử H trong dãy hoạt động hóa học ta sẽ nhận được một muối và giải phóng khí hidro. (Nếu Axit đặc thì sẽ không giải phóng hidro).
Hình 3: Axit tác dụng với kim loại để tạo ra các phản ứng hóa học
3.3. Tác dụng với bazơ
Khi cho dung dịch Axit tác dụng với các Bazơ thì phản ứng sẽ xảy ra mãnh liệt và ta sẽ nhận được một muối và nước. Đây được gọi là phản ứng trung hòa
3.4. Tác dụng với oxit bazơ
Tất cả các axit đều tác dụng với oxit bazơ và tạo thành muối và nước
3.5. Tác dụng với muối
- Khi cho Axit tác dụng với muối sẽ tạo thành các trường hợp sau đây:
- Chất tạo thành có ít nhất 1 kết tủa hoặc một khí bay hơi
- Sau phản ứng, nếu muối mới là muối tan thì axit mới phải yếu, nếu muối mới là muối không tan thì axit mới phải là axit mạnh.
4. Ứng dụng của một số axit
Hiện nay, ứng dụng của axit khá nhiều. Bạn có thể dễ dàng biết được ứng dụng của chúng trong các lĩnh vực công nghiệp.
4.1. Lĩnh vực công nghiệp
Axit được sử dụng để loại bỏ các gỉ sắt, làm sạch bề mặt trước khi hàn, sử dụng để làm chất điện phân trong pin xe hơi, bình acquy; sản xuất phân bón, điều chế các chất tẩy rửa, điều chế dầu mỏ, muối và axit, thuốc nổ, luyện kim, điều chế chất dẻo, tẩy trắng giấy,...
Hình 4: Axit được ứng dụng khá nhiều trong lĩnh vực công nghiệp
4.2. Công nghệ thực phẩm
Axit được sử dụng phổ biến: làm chất tạo màu, điều chỉnh độ chua, chất chống tạo bọt, chất chống vón, chất chống oxy hóa, chất tạo lượng, giữ màu, chất chuyển thể sữa, điều vị, tạo vị, xử lý bột ngũ cốc, giữ ẩm, chất ổn định,...
4.3. Lĩnh vực y tế
Aspirin là một loại thuốc có chứa axit được sử dụng để giảm sốt đã được nghiên cứu từ cuối thế kỷ 19.
4.4. Trong cơ thể người
Axit đóng vai trò vô cùng quan trọng giúp tiêu hóa thức ăn bằng cách phá vỡ các phân tử thức ăn có cấu trúc phức tạp.
Amino axit được yêu cầu để tổng hợp các protein cần thiết cho sự phát triển và sửa chữa các mô cơ thể.
Các axit nucleic rất quan trọng cho việc sản xuất DNA và RNA và chuyển các đặc tính sang con lai qua gen. Axit cacbon rất quan trọng để duy trì độ cân bằng pH trong cơ thể.
Như vậy là bạn vừa tìm hiểu xong về gốc axit là gì cũng như các tính chất của chúng. Hiện nay, các doanh nghiệp ứng dụng gốc axit rất nhiều nhằm bảo quản thực phẩm và tạo ra các sản phẩm phục vụ đời sống. Mong rằng bạn đã hiểu thêm về các gốc axit.
Link nội dung: https://phamkha.edu.vn/ten-goi-cua-axit-a5911.html