
Phản ứng thế: Lý thuyết, ứng dụng và cách giải bài tập
Phản ứng thế là một trong những cơ chế phản ứng cơ bản nhất trong hóa học, được tìm thấy trong cả hóa học vô cơ và hữu cơ. Phản ứng này không chỉ giúp chúng ta hiểu rõ hơn về cấu trúc và tính chất của các chất mà còn có nhiều ứng dụng quan trọng trong thực tiễn. Bài viết này yeuhoahoc.edu.vn sẽ cung cấp một cái nhìn tổng quan về lý thuyết phản ứng thế, ứng dụng và cách giải các bài tập liên quan.
Lý thuyết về phản ứng thế
Phản ứng thế là gì?
Phản ứng thế là sự biến đổi hoá học khi một nguyên tử hoặc nhóm nguyên tử trong một phân tử được thay thế bằng một nguyên tử hoặc nhóm nguyên tử khác.
không thay đổi khung carbon của phân tử.
Đặc điểm của phản ứng thế
Phản ứng thế xảy ra trong dung dịch:
- Hầu hết các phản ứng thế xảy ra trong dung dịch, nơi các ion có thể di chuyển tự do và va chạm với nhau.
- Ví dụ: Phản ứng giữa axit clohydric (HCl) và kẽm (Zn)
Phản ứng thế cần điều kiện:
- Một số phản ứng thế cần điều kiện nhất định như nhiệt độ cao, áp suất cao hoặc có chất xúc tác.
- Ví dụ: Phản ứng giữa khí hydro (H2) và khí clo (Cl2) cần tia lửa điện để kích hoạt phản ứng.
Phản ứng thế không thay đổi cấu trúc cơ bản:
- Phản ứng thế chỉ thay thế một nguyên tử hoặc nhóm nguyên tử trong phân tử gốc bằng một nguyên tử hoặc nhóm nguyên tử khác.
- Cấu trúc cơ bản của phân tử gốc vẫn được giữ nguyên.
- Ví dụ: Phản ứng giữa metan (CH4) và khí clo (Cl2) tạo ra metyl clorua (CH3Cl).
Ngoài ra, cần lưu ý một số điểm sau:
- Phản ứng thế có thể xảy ra giữa các đơn chất và hợp chất, hoặc giữa hai hợp chất.
- Phản ứng thế thường đi kèm với sự tỏa nhiệt.
- Phản ứng thế có thể được sử dụng để điều chế các chất mới.
Phương trình phản ứng thế
Phương trình phản ứng thế mô tả quá trình hóa học trong đó một nguyên tử hoặc nhóm nguyên tử trong một phân tử bị thay thế bằng một nguyên tử hoặc nhóm nguyên tử khác.
Phương trình phản ứng thế được viết theo dạng tổng quát sau:
A + BX → AX + B
Trong đó:
- A là đơn chất hoặc hợp chất.
- BX là hợp chất.
- AX là sản phẩm thế.
- B là sản phẩm phụ.
Ví dụ:
- Phản ứng giữa kẽm (Zn) và axit clohydric (HCl):
Zn + 2HCl → ZnCl2 + H2↑
- Phản ứng giữa khí hydro (H2) và khí clo (Cl2):
H2 + Cl2 → 2HCl
Để viết phương trình phản ứng thế, cần thực hiện các bước sau:
- Xác định loại phản ứng.
- Xác định các chất tham gia và sản phẩm.
- Viết phương trình phản ứng theo dạng tổng quát.
- Cân bằng phương trình phản ứng.
Phản ứng thế trong hóa vô cơ
Phản ứng thế trong hóa vô cơ là phản ứng hóa học mà trong đó một nguyên tố có độ hoạt động hóa học mạnh hơn (ở điều kiện cụ thể về nhiệt độ và áp suất) sẽ thay thế cho nguyên tố có độ hoạt động hóa học yếu hơn trong hợp chất của nguyên tố này.
Dấu hiệu nhận biết
- Có sự biến đổi về số oxi hóa của các nguyên tố.
- Thường xảy ra trong dung dịch.
- Một số phản ứng cần điều kiện nhiệt độ, áp suất hoặc có chất xúc tác.
- Không làm thay đổi cấu trúc cơ bản của phân tử gốc.
Ví dụ:
- Phản ứng giữa kẽm (Zn) và axit clohydric (HCl):
Zn + 2HCl → ZnCl2 + H2↑
- Phản ứng giữa khí hydro (H2) và khí clo (Cl2):
H2 + Cl2 → 2HCl
Phân loại
- Phản ứng thế kim loại:
M + nHX → MXn + H2↑ (M là kim loại đứng trước H trong dãy điện hóa)
ví dụ:Mg + H2SO4 → MgSO4 + H2↑
- Phản ứng thế halogen:
X2 + 2Y → 2XY (X2 là halogen đứng trước Y2 trong dãy hoạt động hóa học của halogen)
ví dụ: Cl2 + 2NaBr → 2NaCl + Br2↑
- Phản ứng thế axit:
HX + YOH → XY + H2O (HX là axit đứng trước YOH trong dãy hoạt động hóa học của axit)
ví dụ: 2HNO3 + MgCO3 → Mg(NO3)2 + H2O + CO2↑
Ứng dụng
- Điều chế kim loại.
- Điều chế khí.
- Điều chế axit.
- Xử lý nước thải.
Phản ứng thế trong hóa hữu cơ
Phản ứng thế trong hóa hữu cơ là phản ứng hóa học mà trong đó một nhóm nguyên tử trong một phân tử hữu cơ được thay thế bởi một nhóm nguyên tử khác.
Dấu hiệu nhận biết
- Có sự thay đổi cấu trúc của phân tử hữu cơ.
- Thường xảy ra trong dung dịch.
- Một số phản ứng cần điều kiện nhiệt độ, áp suất hoặc có chất xúc tác.
Phân loại
- Phản ứng thế ái lực điện tử:
RX + Y- → RY + X-
ví dụ: C2H5OH + NaOH → C2H5ONa + H2O
- Phản ứng thế ái lực hạt nhân:
RX + Không- → R-Không + X-
ví dụ: C6H5OH + NaOH → C6H5ONa + H2O
- Phản ứng thế gốc:
RH + X- → RX + H-
CH4 + Cl2 → CH3Cl + HCl
Ứng dụng
- Điều chế các hợp chất hữu cơ.
- Xử lý môi trường.
- Sản xuất các sản phẩm hóa học
Ứng dụng của phản ứng thế
Phản ứng thế có nhiều ứng dụng quan trọng trong đời sống và sản xuất, bao gồm:
Điều chế kim loại
- Dùng kim loại hoạt động mạnh hơn để khử ion kim loại trong dung dịch muối của kim loại yếu hơn.
- Ví dụ: Dùng Mg để khử ion Cu2+ trong dung dịch CuSO4 để điều chế Cu.
Điều chế khí
- Dùng kim loại tác dụng với axit để điều chế khí H2.
- Ví dụ: Dùng Zn tác dụng với HCl để điều chế H2.
Điều chế axit
- Dùng halogen tác dụng với H2O để điều chế axit halogen.
- Ví dụ: Dùng Cl2 tác dụng với H2O để điều chế HCl.
Xử lý nước thải
- Dùng chất khử để khử các chất độc hại trong nước thải.
- Ví dụ: Dùng Na2S2O3 để khử Cl2 trong nước thải.
Sản xuất các sản phẩm hóa học
- Phản ứng thế được sử dụng để sản xuất nhiều loại hóa chất quan trọng như:
- Nhựa PVC
- Cao su
- Thuốc nhuộm
- Hóa chất nông nghiệp
Phản ứng thế SN1
Định nghĩa
Phản ứng thế
SN1
(hay gọi là phản ứng thế nucleophilic đơn phân tử) là phản ứng thế nucleophilic trong đó bước xác định tỷ lệ phản ứng là sự phân rã chậm của chất nền để tạo thành cacbocation, sau đó nucleophile mới tấn công cacbocation này.
Cơ chế phản ứng thế SN1

Bước 1: Phân rã chậm của chất nền để tạo thành cacbocation (carbocation) và ion âm.
Bước 2: Nucleophile tấn công cacbocation để tạo thành sản phẩm.
Ví dụ phản ứng thế SN1
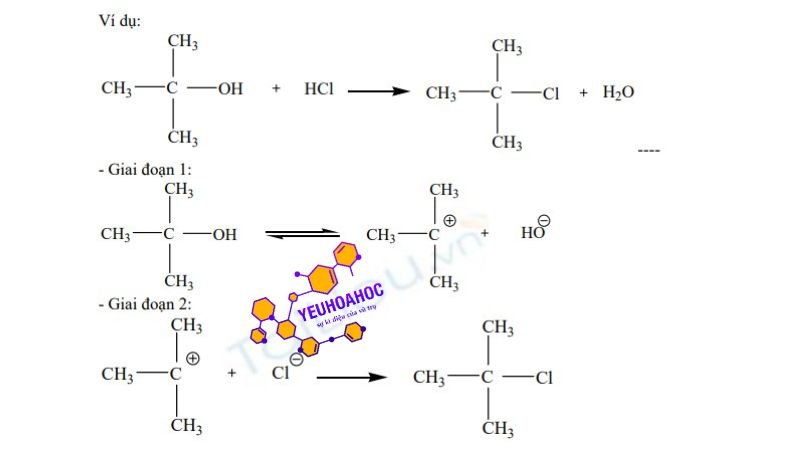
Nhận xét: Cơ chế
SN1
xảy ra qua hai giai đoạn. Ở giai đoạn ban đầu, nhóm X được phân ly thành anion X- tạo thành cacbocation, các cation này thường được solvat hóa một cách không đồng đều. Trong giai đoạn thứ hai, cacbocation thường rất không ổn định và phản ứng ngay lập tức với bất kỳ tác nhân nucleophile nào ở xung quanh. Giai đoạn này diễn ra nhanh chóng và phụ thuộc vào tương tác tĩnh điện, được đánh giá thông qua lực Coulomb. Sơ đồ phản ứng được mô tả như sau:
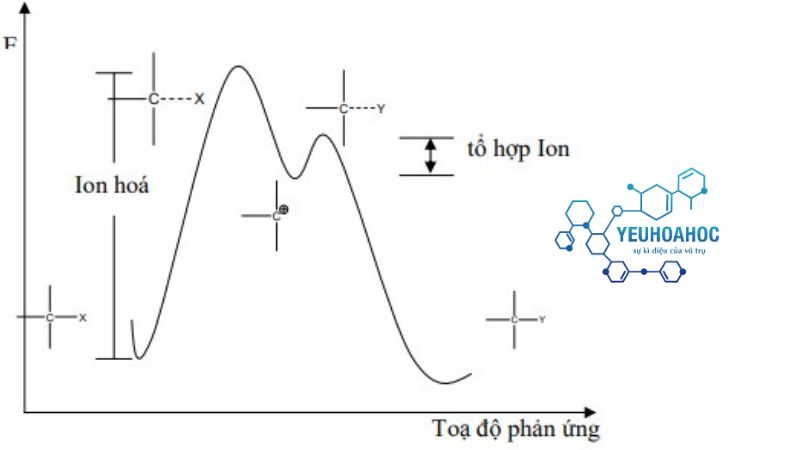
Giai đoạn quan trọng quyết định tốc độ phản ứng là giai đoạn ion hoá. Người ta đã chứng minh rằng giai đoạn ion hoá có tính chất thuận nghịch (chiều thuận chậm hơn chiều nghịch rất nhiều).
Đặc điểm
Tốc độ phản ứng phụ thuộc vào:
- Nồng độ chất nền
- Cấu trúc chất nền (khả năng tạo cacbocation)
- Bản chất nucleophile
- Dung môi
- Phản ứng thường xảy ra với các chất nền có khả năng tạo cacbocation bền.
- Phản ứng thường xảy ra trong dung môi phân cực.
Ứng dụng
- Phản ứng thế SN1được ứng dụng trong nhiều lĩnh vực như:
- Hóa học hữu cơ
- Hóa sinh
- Dược phẩm
Phản ứng thế SN2
Định nghĩa
Phản ứng thế
SN2
(hay gọi là phản ứng thế nucleophilic lưỡng phân tử) là phản ứng thế nucleophilic trong đó nucleophile tấn công trực tiếp vào nguyên tử carbon có nhóm thế X, đồng thời đẩy X ra khỏi phân tử.
Cơ chế phản ứng thế SN2
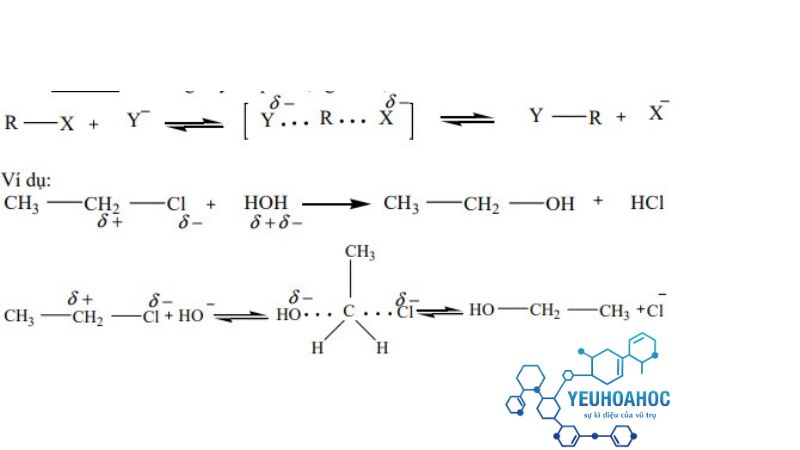
Phản ứng xảy ra qua một giai đoạn
Nucleophile tấn công trực tiếp vào nguyên tử carbon có nhóm thế X.
Nhóm thế X bị đẩy ra khỏi phân tử.
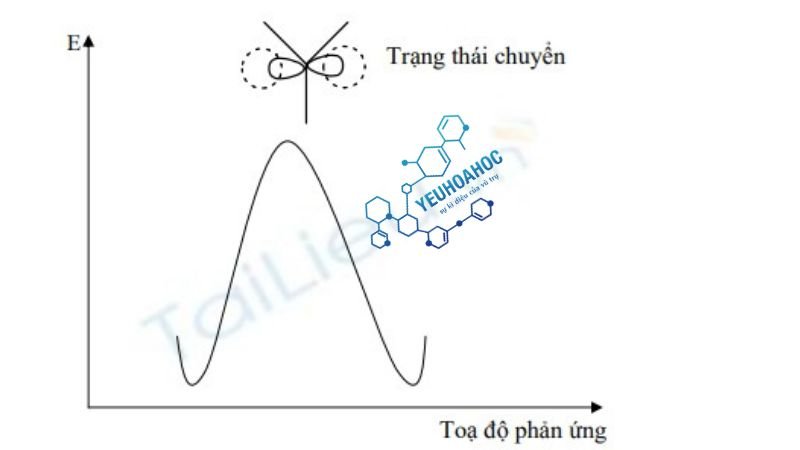
Nhận xét: Cơ chế
SN2
diễn ra qua một giai đoạn duy nhất, gọi là cơ chế đồng bộ, không tạo ra các hợp chất trung gian và dẫn đến trạng thái chuyển lưỡng phân tử, quyết định tốc độ của phản ứng. Sơ đồ năng lượng của phản ứng
SN2
được mô tả như sau:
Đặc điểm
- Tốc độ phản ứng phụ thuộc vào:
- Nồng độ nucleophile
- Nồng độ chất nền
- Cấu trúc chất nền (khả năng cản trở steric)
- Bản chất nucleophile
- Dung môi
- Phản ứng thường xảy ra với các chất nền có ít hoặc không có cản trở steric.
- Phản ứng thường xảy ra trong dung môi phân cực aprotic.
Ứng dụng
- Phản ứng thế SN2được ứng dụng trong nhiều lĩnh vực như:
- Hóa học hữu cơ
- Hóa sinh
- Dược phẩm
So sánh phản ứng thế SN1
và
SN2
Đặc điểm Phản ứng thế
SN1
Phản ứng thếSN2
Cơ chế Phân rã chậm của chất nền tạo cacbocation, sau đó nucleophile tấn công cacbocation Nucleophile tấn công trực tiếp vào nguyên tử carbon có nhóm thế X Tốc độ Phụ thuộc vào nồng độ chất nền Phụ thuộc vào nồng độ nucleophile Cấu trúc chất nền Thường xảy ra với các chất nền có cấu trúc bậc 3 Thường xảy ra với các chất nền có cấu trúc bậc 1 Dung môi Thường xảy ra trong dung môi phân cực Thường xảy ra trong dung môi phân cực aprotic Ví dụ Phản ứng solvolyse của tert-butyl chloride trong nước Phản ứng của methyl iodide với hydroxideỨng Dụng của Phản Ứng Thế
Phản ứng thế là một loại phản ứng hóa học phổ biến với nhiều ứng dụng quan trọng trong nhiều lĩnh vực, bao gồm:
Hóa học hữu cơ
- Điều chế ancol: Phản ứng thế giữa halogenankan và dung dịch KOH/NaOH.
- Điều chế ete: Phản ứng thế giữa halogenankan và ancolat natri/kali.
- Điều chế amin: Phản ứng thế giữa halogenankan và amoniac.
- Phản ứng cộng hợp: Phản ứng thế giữa anken và dung dịch HBr/HCl.
Hóa học vô cơ
- Điều chế kim loại: Phản ứng thế giữa dung dịch muối kim loại và kim loại hoạt động hơn.
- Điều chế axit: Phản ứng thế giữa oxit kim loại và dung dịch axit.
- Điều chế muối: Phản ứng thế giữa dung dịch muối và kim loại hoặc dung dịch muối khác.
Phân tích hóa học
- Xác định hàm lượng kim loại: Phản ứng thế giữa dung dịch muối kim loại và dung dịch chuẩn.
- Xác định hàm lượng halogen: Phản ứng thế giữa halogenua và dung dịch AgNO3.
Công nghiệp
- Sản xuất axit, bazơ, muối: Phản ứng thế được sử dụng để sản xuất nhiều loại hóa chất quan trọng trong công nghiệp.
- Luyện kim: Phản ứng thế được sử dụng để loại bỏ tạp chất trong kim loại.
- Sản xuất cao su tổng hợp: Phản ứng thế được sử dụng để tổng hợp các loại cao su.
Y học
- Điều chế thuốc: Phản ứng thế được sử dụng để điều chế một số loại thuốc.
- Chẩn đoán bệnh: Phản ứng thế được sử dụng trong một số xét nghiệm chẩn đoán bệnh.
Các dạng bài tập cơ bản trong phản ứng thế
Phương pháp giải bài tập thế halogen
- Xác định loại phản ứng:
- Phản ứng thế halogen của ankan thường xảy ra theo cơ chế gốc tự do.
- Ánh sáng hoặc nhiệt độ là điều kiện cần thiết để phản ứng xảy ra.
- Viết phương trình phản ứng:
- Xác định các sản phẩm chính và phụ của phản ứng.
- Viết phương trình phản ứng theo cơ chế gốc tự do.
- Cân bằng phương trình phản ứng:
- Cân bằng số nguyên tử của từng nguyên tố.
- Giải bài tập:
- Dựa vào yêu cầu của bài tập để giải.
- Ví dụ: tính toán khối lượng, thể tích, số mol,…
Một số lưu ý:
- Phản ứng thế halogen của ankan thường xảy ra theo tỉ lệ 1:1.
- Tốc độ của phản ứng phụ thuộc vào nhiều yếu tố như
- Ánh sáng: Ánh sáng có cường độ cao sẽ đẩy nhanh tốc độ phản ứng.
- Nhiệt độ: Nhiệt độ cao sẽ đẩy nhanh tốc độ phản ứng.
- Loại halogen: Cl2 > Br2 > I2.
- Cấu trúc ankan: Ankan bậc 1 > Ankan bậc 2 > Ankan bậc 3.
Ví dụ:
Bài tập: Cho 5,6 lít khí metan (CH4) tác dụng với khí clo dư theo tỉ lệ mol 1:1. Tính khối lượng sản phẩm chính thu được.
Giải:
Bước 1: Xác định loại phản ứng.
- Phản ứng thế halogen của ankan.
Bước 2: Viết phương trình phản ứng.
- CH4 + Cl2 → CH3Cl + HCl
Bước 3: Cân bằng phương trình phản ứng.
- CH4 + Cl2 → CH3Cl + HCl
Bước 4: Giải bài tập.
- nCH4 = 5,6 / 22,4 = 0,25 mol
- nCH3Cl = nCH4 = 0,25 mol
- mCH3Cl = 0,25 x 50,5 = 12,625 gam
Vậy khối lượng sản phẩm chính thu được là 12,625 gam.
Bài tập phản ứng thế hidro
Ví dụ 1: Cho 5,6 gam Fe tác dụng với dung dịch HCl dư. Tính thể tích khí H2 thu được (đktc).
Lời giải:
Bước 1: Viết phương trình phản ứng xảy ra.
Fe + 2HCl -> FeCl2 + H2↑
Bước 2: Xác định chất phản ứng hết, chất dư (nếu có).
- So sánh số mol của Fe và HCl:
n(Fe) = m(Fe) / M(Fe) = 5,6 gam / 56 g/mol = 0,1 mol
n(HCl) = C(HCl) * V(HCl) = (dư)
Vì n(Fe) < n(HCl) nên Fe phản ứng hết, HCl dư.
Bước 3: Tính toán số mol của chất phản ứng hết.
- n(Fe) = 0,1 mol
Bước 4: Dựa vào phương trình phản ứng, tính toán số mol của các chất khác theo chất phản ứng hết.
- n(H2) = n(Fe) = 0,1 mol
Bước 5: Tính toán khối lượng của các chất theo số mol.
- V(H2) = n(H2) * V(H2) (đktc) = 0,1 mol * 22,4 lít/mol = 2,24 lít
Kết quả: Thể tích khí H2 thu được là 2,24 lít.
Ví dụ 2: Cho 100 ml dung dịch NaOH 1M tác dụng với 200 ml dung dịch HCl 0,5M. Tính pH của dung dịch thu được.
Lời giải:
Bước 1: Viết phương trình phản ứng xảy ra.
NaOH + HCl -> NaCl + H2O
Bước 2: Xác định chất phản ứng hết, chất dư (nếu có).
- So sánh số mol của NaOH và HCl:
n(NaOH) = C(NaOH) * V(NaOH) = 1M * 0,1 lít = 0,1 mol
n(HCl) = C(HCl) * V(HCl) = 0,5M * 0,2 lít = 0,1 mol
Vì n(NaOH) = n(HCl) nên cả NaOH và HCl đều phản ứng hết.
Bước 3: Tính toán số mol của chất phản ứng hết.
- n(NaOH) = n(HCl) = 0,1 mol
Bước 4: Dựa vào phương trình phản ứng, tính toán số mol của các chất khác theo chất phản ứng hết.
- n(NaCl) = n(NaOH) = 0,1 mol
Bước 5: Tính toán nồng độ mol của các chất trong dung dịch thu được.
- Vdd = V(NaOH) + V(HCl) = 0,1 lít + 0,2 lít = 0,3 lít
- C(NaCl) = n(NaCl) / Vdd = 0,1 mol / 0,3 lít = 0,33M
Bước 6: Tính pH của dung dịch thu được.
- Dung dịch thu được sau phản ứng là dung dịch muối NaCl, là dung dịch trung hòa, có pH = 7.
Kết quả: pH của dung dịch thu được là 7.
Link nội dung: https://phamkha.edu.vn/index.php/phan-ung-the-a25340.html